Brandschutztipp
- Feuer
Brandschutztipp
- Feuer
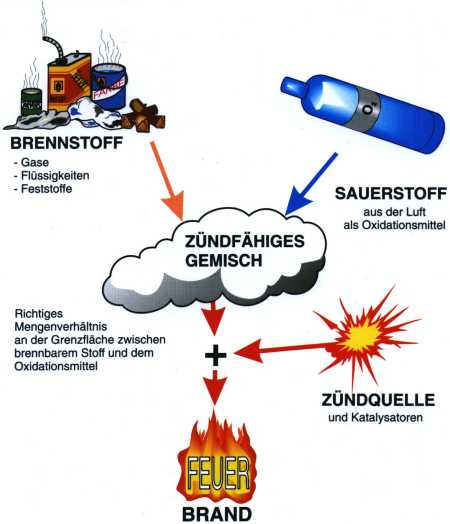
In
jeder Verbrennungsreaktion verbindet sich Sauerstoff mit einem Brennstoff, der
meist aus organischem Material ist. Das heißt, er enthält große Anteile an Kohlenstoff
und Wasserstoff. Bei diesem Vorgang lösen sich die organischen Verbindungen
auf und gehen Schritt für Schritt in einfach gebaute, kleine Moleküle über:
Kohlenmonoxid, Kohlendioxid, Wasser. Übrig bleiben außerdem jene anorganischen
Rückstände, zum Beispiel Mineralstoffe, die wir als Asche bezeichnen.
 Die
Endprodukte der Verbrennung besitzen eine Gemeinsamkeit: in ihren Bindungen
steckt sehr viel weniger Energie als in denen der Ausgangssubstanz. Bei einer
Verbrennung wird also ständig Energie frei gesetzt.
Die
Endprodukte der Verbrennung besitzen eine Gemeinsamkeit: in ihren Bindungen
steckt sehr viel weniger Energie als in denen der Ausgangssubstanz. Bei einer
Verbrennung wird also ständig Energie frei gesetzt.
Um ein Feuer zu entzünden, ist eine Aktivierungsenergie notwendig, zum Beispiel
in Form einer Streichholzflamme. Sie lässt einige Moleküle des Brennstoffs verdampfen
und dann zerbrechen (pyrolysieren). Die Bruchstücke reagieren mit Sauerstoff
oder greifen als sogenannte Radikale weitere Kohlenstoffketten an. Von jetzt
an erhält das Feuer sich selbst: Immer, wenn eine neue Verbindung entsteht,
wird so viele Energie frei, dass das nächste Molekül zerbricht. Entweicht die
Energie, spüren wir sie als Hitze.
Flammen sind dabei glühende Gase und Ruß. Seine Kohlenstoffpartikel sind auf
1200°C erhitzt und strahlen als orange-gelbes Licht. Blaue Flammen sind dagegen
kleine Molekülfragmente, die bis zu 1800°C heiß werden.